| ��S�ҁ@�L�@������
��R�́@�A���R�[���Ɗ֘A������
|
|
1�A���R�[���ƃG�[�e���@2�A���f�q�h�ƃP�g��
3���b���J���{���_�Ǝ_�������@
4�G�X�e���Ɩ���
|
|
|
�P�@�A���R�[���ƃG�[�e����
�y�A���R�[���z
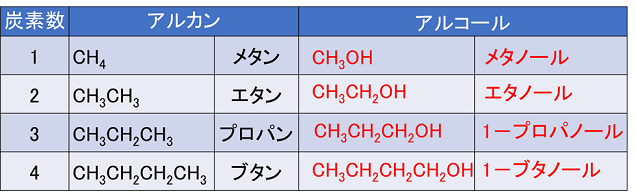
�Y�����f�̐��f���q���k�@�q�h���L�V��
-OH�@�l�Œu�����������������A���R�[���Ƒ��̂���B�A���R�[���̖��̂�-OH�����������Œ��̒Y�f�����卽�Ƃ��āC����ɑ�������Y�����f���̌����e��ol�ɕς����B�ȒP�ɂ����C�A���J�����́u���v���u�m�[���v�ɕς���B-OH�̈ʒu���������Ȃ�悤�ɁC�Y�f���ɔԍ���t���C-OH�̈ʒu�������B
|
 |
|
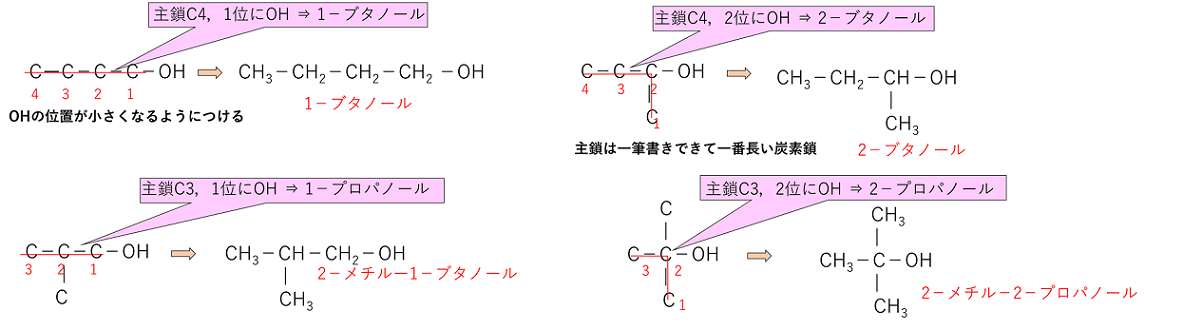
���@C��3�ȏ�̃A���R�[���ɂِ͈��̂�������B
�@�@��@C4H9OH�@�@�@�@�@�卽C4�C1�ʂ�OH�@���@1�|�u�^�m�[��
|
 |
|
�A���R�[���̕����@�i���̕��އ@�ƇA�͍������₷���̂ŁC��������o���邱�Ɓj
�@���q�����Y�f�̐��ɂ�镪��
�Y�f���̏��Ȃ��iC=6�ȉ��j�A���R�[����ዉ�A���R�[���C�Y�f���̑����A���R�[���������A���R�[���Ƃ����B
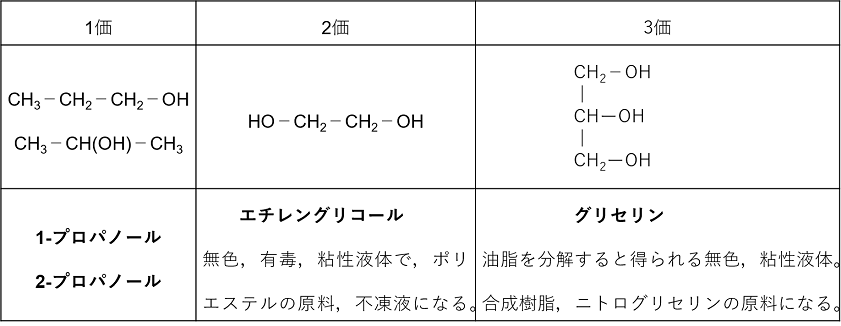
�A���q���� -OH�̐��ɂ�镪��
���q���Ƀq�h���L�V��-OH��1�̂��̂��ꉿ�A���R�[���C2�̂��̂�A���R�[���C3�̂��̂��O���A���R�[���Ƃ����B2���ȏ�̂��̂𑽉��A���R�[���Ƃ����B
|
 |
|
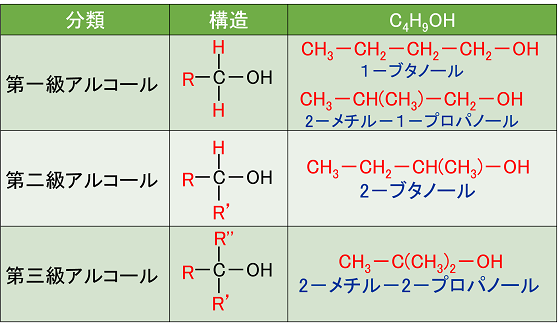
�B���q���� -OH���������Ă���Y�f���q�ɂ�镪��
�q�h���L�V��̌������Ă���Y�f���q�ɁC�Y�����f��R�����������Ă��邩�ɂ���āC��ꋉ�A���R�[��,��A���R�[��,��O���A���R�[���ɕ��ނ����B�E��C4H9OH�̊e�ِ��̂ނ���BR�͒Y�����f��i���`����C�G�`����Ȃǁj
|
 |
|
�y�A���R�[���̐����z
�A���R�[���̕��_�@
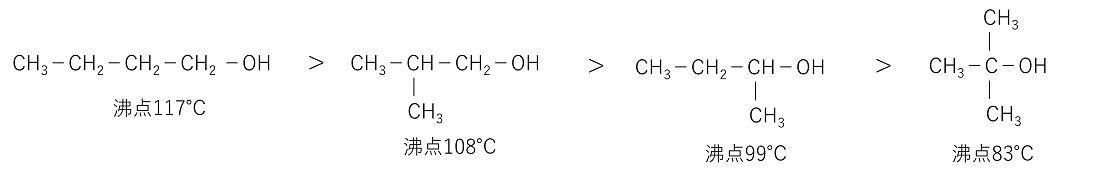
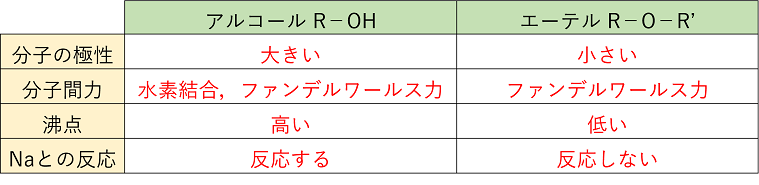
�A���R�[���͕��q�ԂŁk�@���f�����@�l���`������̂ŁC���q�ʂ̎����Y�����f�ɔ�ו��_�E�Z�_�������B�A���R�[���̕��_�́C�Y�f������������ɂꕪ�q�ʂ��傫���Ȃ�@�k�@�t�@���f�����[���X���@�l���傫���Ȃ�̂ō����Ȃ�B�܂������Y�f���̃A���R�[���ł���ꋉ�A���R�[���C��A���R�[���C��O���A���R�[���̏��ɁC��ꋉ�ǂ����ł́C�����\���̕����}������\���������_�������Ȃ��B�����-OH�̂܂��̍\�������ݍ����Ă���Ɛ��f�������`�����ɂ����Ȃ邽�߂ł���B
�@C4H9OH�ł� |
 |
|
�A���R�[���̐��ւ̗n��x�i���ւ̗n���₷���j
�A���R�[���̐��ւ̗n��x�́k�@�Y�f���@�l�����Ȃ��C�k�@�q�h���L�V���@�l�̐��������قǗn��x�͑傫���Ȃ�B�Ⴆ�C�Y�f����3�̃v���p�m�[���܂ł͐��ƔC�ӂ̊����ŗn���������C��������Y�f���������ƁC�n��x�͒ቺ����B
|
|
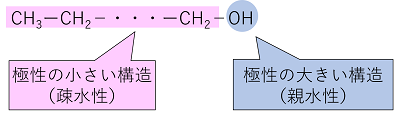
�i���R�j�A���R�[���̒Y�f���̕����͋ɐ����������C�ɐ����q�ł��鐅�Ƃ͂Ȃ��݂ɂ����a�����i�܂��͐e�����j�ł���B����C�q�h���L�V��͋ɐ����傫�����ƂȂ��݂₷���e�����ł��邽�߁C�Y�f���������Ƒa�����������Ȃ�C�q�h���L�V������Ɛe�����������Ȃ邽�߂ł���B
|
 |
|
|
�A���R�[���̒u�������i�i�g���E���Ƃ̔����j
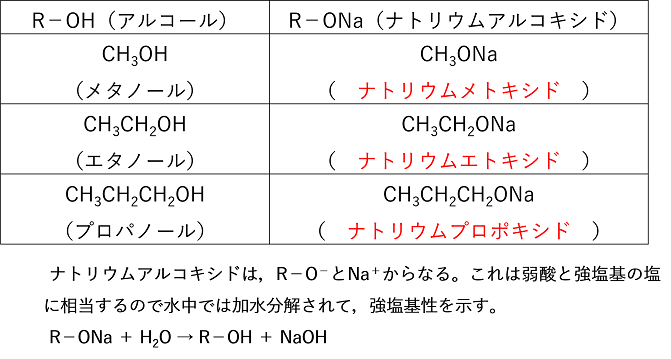
�@�A���R�[��R�|OH�ɋ����i�g���E����������ƁC���f�����C�i�g���E���A���R�L�V�hR�|ONa������B
�@�@�@�@�@�@2R�|OH�@�{�@Na�@���@2R�|ONa�@�{�@H2
|
 |
|
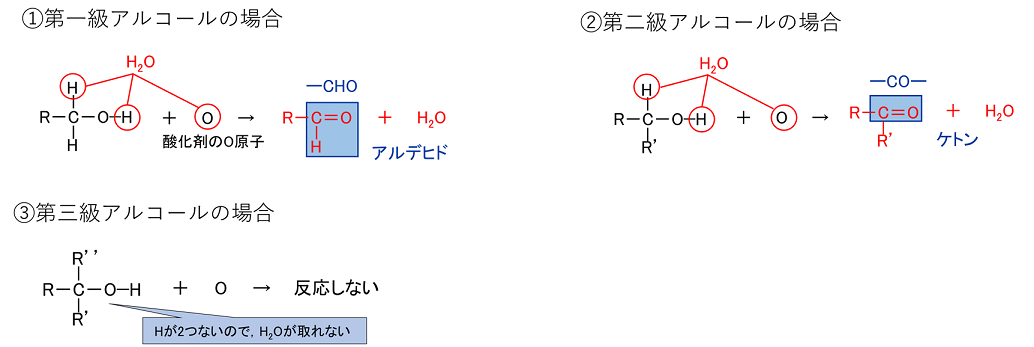
�A���R�[���̎_�������i�E���f�����j
�A���R�[�����_������ƁC�A���R�[�����q���̐��f���q�Ǝ_���܁i�_�f���q�j���������āC�����ł���B�܂�C�A���R�[�����q���琅�f���q��2�O��锽���B
|
 |
|
���̂悤�ɁC��ꋉ�A���R�[�����_������Ɓk�@�A���f�q�h�@�l�C��A���R�[�����_������Ɓk�@�P�g���@�l����������B�܂��C��O���A���R�[���͎_������Ȃ��B
�y���^�m�[���ƃG�^�m�[���z
���^�m�[���iCH3OH�j�̓��`���A���R�[���Ƃ������C���ƔC�ӂ̊����ŗn�������L�łȉt�̂ł���B��_���Y�f�Ɛ��f���獇���@�����B
�G�^�m�[���iCH3CH2OH�j�̓G�`���A���R�[���Ƃ������B���ƔC�ӂ̊����ŗn�������t�̂ŁC�f���v����u�h�E���i�O���R�[�X�jC6H12O6���y��Ȃǂ̔������ɂ���ĕ�������Ɛ�������B������A���R�[�����y�A�Ƃ����B�H�ƓI�ɂ́C�G�`�����ɐ���t���B�����Ă���B
�@�@�@�k�@CO�@�{ 2H2�@���@CH3�|OH�@�l�@�@�@�A�@�k�@C6H12O6�@���@2CH3�|CH2�|OH�@�{�@2CO2�@�l�@�@�@
�B�@�k�@CH2��CH2�@�{�@H2O�@���@CH3�|CH2�|OH�@�l
�y�G�[�e���z
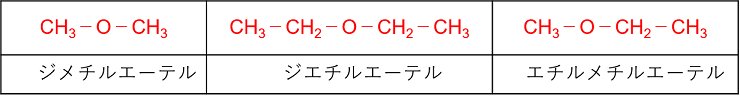
�@�_�f���q��2�̒Y�����f���������R-O-R�f���k�@�G�[�e���@�l�Ƃ����C-O-�̌������k�@�G�[�e�������@�l�Ƃ����B�G�[�e����1���A���R�[���i��d������O�d�������������C-OH��1�������A���R�[���j�ƍ\���ِ��̂̊W�ɂ����B
�G�[�e���̖����͒Y�����f��i�A���L����j�̖��̂��A���t�@�x�b�g���ɕ��ׂāC���̌�Ɂu�G�[�e���v�Ƃ���B
|
 |
|
����@C4H10O�ŕ\�����\�������ׂď����B
�A���R�[���@C4H9�|OH��4��
�@CH3�|CH2�|CH2�|CH2�|OH�@�@CH3�|CH(CH3)�|CH2�|OH�@�@CH3�|CH2�|CH(OH)�|CH3�@�@�@(CH3)3C�|OH
�G�[�e��
�@CH3�|O�|CH2�|CH2�|CH3�@�@CH3�|O�|CH(CH3)�|CH3�@�@�@CH3�|CH2�|O�|CH2�|CH3
�@���q�ʂ������x�̃A���R�[���ƃG�[�e���̔�r
|
 |
|
�W�G�`���G�[�e��
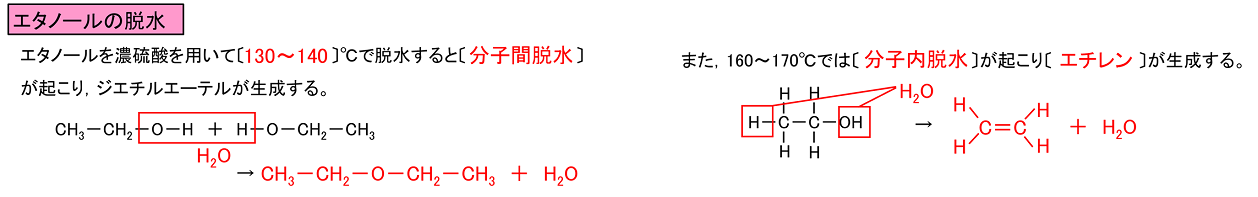
�W�G�`���G�[�e���iCH3-CH2-O-CH2-CH3�j�͒P�ɃG�[�e���Ƃ�������������₷���i�������₷���j�t�̂ŁC������������B���̏��C�͋�C�����y���C�����₷���B���ɂ͗n���ɂ����C�L�@���������悭�n�����̂ŁC�n�܂Ƃ��ėp������B�G�^�m�[����Z���_��p���āk�@130�`140�@�l���ŒE������Ɓk ���q�ԒE���@�l���N����C�W�G�`���G�[�e������������B�i�Z���_�ɂ͒E����p������B�j�܂��C160�`170���ł́k�@���q���E���@�l���N����k�@�G�`�����@�l����������B
|
 |
|
����@���q����C4H10O�Ŏ������\���ِ��̂ɂ�7��ނ���B�����ِ̈��̂����̎w���ɏ]���ĕ��ނ��C�\�����ŋL���B
(1)�@�_������ƃA���f�q�h������́@�@(2)�@�_������ƃP�g���������
(3)�@�_������Ȃ��������i�g���E���Ɣ��������f���������
(4)�@�����i�g���E���Ɣ������Ȃ�����
�@C4H10O�͗��16��7��
(1)�@CH3�|CH2�|CH2�|CH2�|OH�@�@CH3�|CH(CH3)�|CH2�|OH�@�@�@(2)�@CH3�|CH2�|CH(OH)�|CH3�@�@
�@
�@(3)�@(CH3)3C�|OH
(4)�@CH3�|O�|CH2�|CH2�|CH3�@�@CH3�|O�|CH(CH3)�|CH3�@�@�@CH3�|CH2�|O�|CH2�|CH3
|
 |